2022年5月26日,99905银河官方网校友、上海交通大学医学院/上海市免疫学研究所梁启明课题组在Nature Immunology上发表了题为“KSHV-encoded ORF45 activates human NLRP1 inflammasome”的研究论文。该研究揭示了细胞受体NLRP1在卡波氏肉瘤相关疱疹病毒(KSHV)感染过程中通过识别其结构蛋白ORF45激活炎症小体(Inflammasomes)的分子机制,并发现NLRP1的Linker1区域对其自抑制体的形成和炎症小体的激活至关重要,为炎症小体活化机制的研究提供了新思路。

课题组发现KSHV感染可以诱导炎症小体的组装和激活,并且该激活并不依赖于病毒DNA和细胞DNA受体IFI16的识别。通过对KSHV所编码病毒蛋白的全面筛选,发现其结构蛋白ORF45的表达可以直接激活细胞内炎症小体,诱导炎症因子IL-1β的产生和细胞焦亡。通过酵母双杂交实验,研究团队鉴定发现人源NLRP1是ORF45激活炎症小体的受体。在细胞中敲除NLRP1可以抑制KSHV感染或ORF45表达所诱导的炎症小体激活,并且缺失ORF45的KSHV(KSHV△ORF45)不能诱导炎症小体激活。进一步研究发现位于PYD与NACHT结构域之间的Linker1区域对人源NLRP1自抑制体的形成至关重要,Linker1通过与NLRP1CT的UPA结构域结合,限制NLRP1CT的活化。ORF45通过与Linker1结合,竞争性抑制NLRP1NT与NLRP1CT之间的互作,导致活化的NLRP1CT在细胞质中与ASC和caspase1组装成炎症小体(图1)。在激活的过程中,NLRP1NT与ORF45从细胞质迁移到细胞核中,并不发生经典的功能性降解。ORF45也不影响NLRP1与DPP9之间的结合,且VbP也不影响ORF45对NLRP1的激活。同时ORF45对NLRP1的激活在灵长类中非常保守。综上所述,在KSHV感染过程中细胞受体NLRP1通过识别病毒结构蛋白ORF45激活炎症小体,从而诱发炎症反应,该全新的激活方式仅依赖于Linker1区域对ORF45的识别,并不依赖于经典的功能性降解,也不需要细胞因子DPP9的参与。该研究揭示了全新的NLRP1炎症小体非经典的激活途径,重新定义了人源NLRP1的两个自抑制体的存在模式和作用机制,阐明了病毒的结构蛋白而非病毒DNA是KSHV激活炎症小体的主要配体。
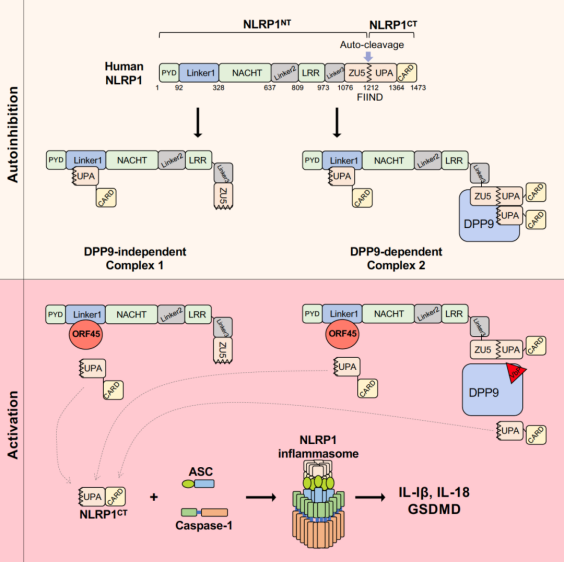
图1. KSHV结构蛋白ORF45激活NLRP1炎症小体的分子机制
消息来源:上海市免疫学研究所微信公众号
梁启明研究员简介

梁启明,研究员,博士生导师。2007年本科毕业于99905银河官方网,2011年在佛罗里达州立大学获得博士学位,2016年在南加州大学Keck医学院完成博士后研究。2016年8月加入上海交通大学医学院/上海市免疫学研究所并担任课题组长,以肿瘤病毒和新发病毒为模式病毒,研究病毒与宿主互作机制。相关研究以通讯作者发表在Nature Immunology(2022)、Cell Stem Cell(2016,2020)、Med(2021)、PLOS Pathogens(2021, 2022)等期刊。梁启明研究员于2015年入选美国白血病和淋巴瘤学会Special Fellow,2016年获得上海市高校特聘教授(东方学者),2017年入选国家海外高层次青年人才项目。目前主持国家重点研发计划(合成生物学)子课题,国家自然科学基金以及上海市教委、科委和卫健委等项目。