1月18日,《Nature Biomedical Engineering》杂志以封面文章形式刊登了99905银河官方网滕乐生教授与美国俄亥俄州立大学L. James Lee教授、德州大学安德森癌症中心Betty Y. S. Kim教授合作论文《Large-scale generation of functional mRNA encapsulating exosomes via cellular nanoporation》(Nature Biomedical Engineering,4,69-83:(2020))(图1)


图1论文首页
外泌体是从活细胞中分泌的纳米级囊泡,能够在细胞间传递蛋白质、mRNA、miRNA等遗传信息。基于外泌体天然的结构和功能特征,其具有天然的靶向性,同时又不会引起促炎反应和免疫反应,因此成为药物递送的理想选择。但是从细胞中分离的外泌体产量少、mRNA的装载效率低以及递送效率差仍然是现阶段研究中亟待解决的问题【1,2】。本文成功开发了一种细胞纳米穿孔技术(Cellular nanoporation,CNP),使用光刻蚀和深反应离子刻蚀相结合的工艺,制成了含纳米孔道的生物芯片,加载瞬时电脉冲后,质粒从缓冲液穿梭到附着在生物芯片的细胞中,以刺激细胞产生和释放外泌体,同时增加内源性mRNA的转录;以此为基础对外泌体进行载药及修饰,修饰后的外泌体在小鼠脑胶质瘤体内、外治疗中均取得较好效果。(图2)。
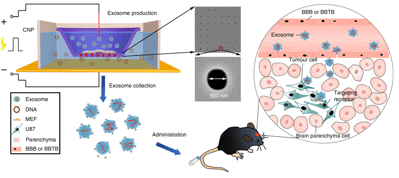
图2 CNP法制备功能性外泌体及其在脑胶质瘤中的应用流程图
实验结果显示,与传统的电转法相比,CNP产生的外泌体数量多出50倍以上,外泌体中mRNA转录效率增加了1000倍,在提高产量的同时大大简化了功能性外泌体的产生过程。进一步的研究表明,外泌体产量及转录效率提高的细胞机制比较独特,是通过CNP技术造成的局灶性细胞膜损伤和局部加热导致HSPs上调和细胞内Ca2+升高【3,4】,进而激活了P53-TSAP6途径【5-8】,导致大量细胞内囊泡的形成,促进外泌体产生和分泌(图3)。
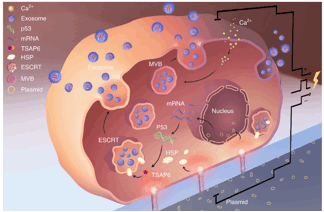
图3 CNP法促进外泌体产生和分泌示意图
在此基础上,团队对外泌体进行功能化修饰,通过在外泌体表面表达的跨膜蛋白CD47的N端(膜外侧)克隆靶向神经胶质瘤的肽(FKESWREARGTRIERG和CREKA)来提高外泌体在U87和GL261胶质瘤细胞的靶向性。基于CNP技术将PTEN和CDX(克隆靶向肽的CD47)两种质粒转入胶质瘤细胞后得到大量具有靶向性的功能性外泌体(Exo-T),在体外具有增强的细胞摄取以及上调了PTEN蛋白的表达。Exo-T在U87胶质瘤免疫缺陷小鼠模型和具有免疫能力的GL261胶质瘤模型中都具有很好的治疗效果(图4)。
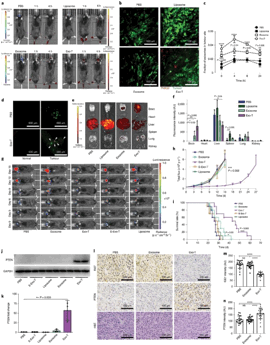
图4 功能性外泌体在脑胶质瘤小鼠治疗中的应用
总体来说,本研究开发了一种新的细胞纳米穿孔技术,利用生物芯片促使细胞大量分泌外泌体,并且简化了外泌体装载内源转录mRNA的方法,一系列研究为外泌体在药物递送方面的应用提供了新的思路及方法,具有理论意义和应用价值。瑞典卡罗莱纳研究所 Andaloussi教授为本文撰写的点评文章《Functional Extracellular Vesicles Aplenty》也发表在同期杂志上。(图5)

图5 点评文章
滕乐生教授致力于生物制药领域的研究与开发,主要从事药物新制剂的应用基础研究、技术研发发及产品转化应用等方面的的探究,2019年还以联系人身份在Nano letters ,Theranostics等国际一流期刊上发表论文。